近日,公司及全资子公司德丰瑞研发的BDB-001注射液(抗C5a单克隆抗体)治疗进展期重型COVID-19的多中心、开放、随机平行对照的II期临床试验完成印度尼西亚首例患者给药。
该临床试验属于中国“多中心、开放、随机平行对照评价BDB-001注射液治疗重型新型冠状病毒肺炎(COVID-19)的有效性、安全性的II/III期临床研究”的一部分,旨在全球开展国际多中心临床研究以支持在中国的上市注册。
关于BDB-001注射液
近30年的超过4000篇PubMed研究报告提示补体C5a分子是急性感染、组织损伤炎症早期出现的最强因子,被公认为是广谱炎性放大器,是补体过度激活导致剧烈炎症反应的主要效应分子,是感染、损伤急救药的理想靶点。
BDB-001注射液是针对人C5a分子的单克隆抗体药物,能特异性结合C5a,使C5a丧失结合受体的能力,从而阻断其诱导的生物学功能,如中性粒细胞趋化、细胞内溶菌酶的释放、炎性细胞因子水平上升和氧呼吸爆发等,抑制炎症级联反应,从而控制炎症进一步发展,且不抑制免疫功能。同时不影响C5裂解及膜攻击复合物(MAC)的形成,保留了补体介导的溶菌作用。
BDB-001注射液的注册信息
BDB-001注射液于2018年02月07日获得了国家食品药品监督管理总局治疗中重度化脓性汗腺炎的临床试验申请受理;于2018年07月获得批准进行临床研究。
2020年第一季度,在国内疫情发展迅速、疫情防控所需药品急缺的紧要关键时刻,公司及全资子公司德丰瑞克服多重困难,凭借对人补体C5a分子为作用靶点的BDB-001项目的基础药理作用、临床试验应用的深刻理解,持续推进BDB-001项目的研发工作,于2020年01月向国家药监局提出BDB-001注射液用于治疗冠状病毒感染所致重症肺炎和冠状病毒感染所致相关疾病的临床试验申请,并于2020年02月07日获得临床试验批件。2020年06月底,公司与国家药监局技术审评部门进行沟通并获得回复,暂停普通型肺炎临床试验;修改重型肺炎临床试验方案为“多中心、开放、随机平行对照评价BDB-001注射液治疗重型新型冠状病毒肺炎(COVID-19)的有效性、安全性的II/III期临床研究方案”,旨在全球开展国际多中心临床研究以支持在中国的上市注册。
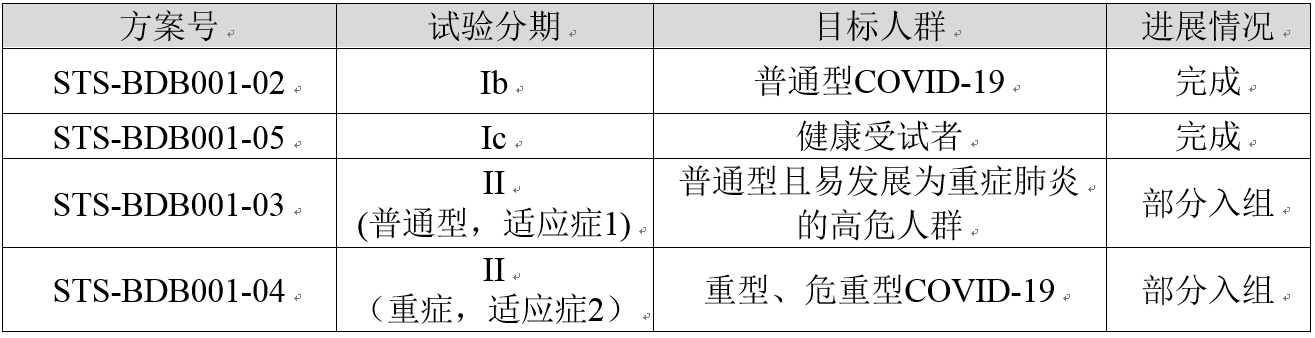
BDB-001注射液的临床试验信息
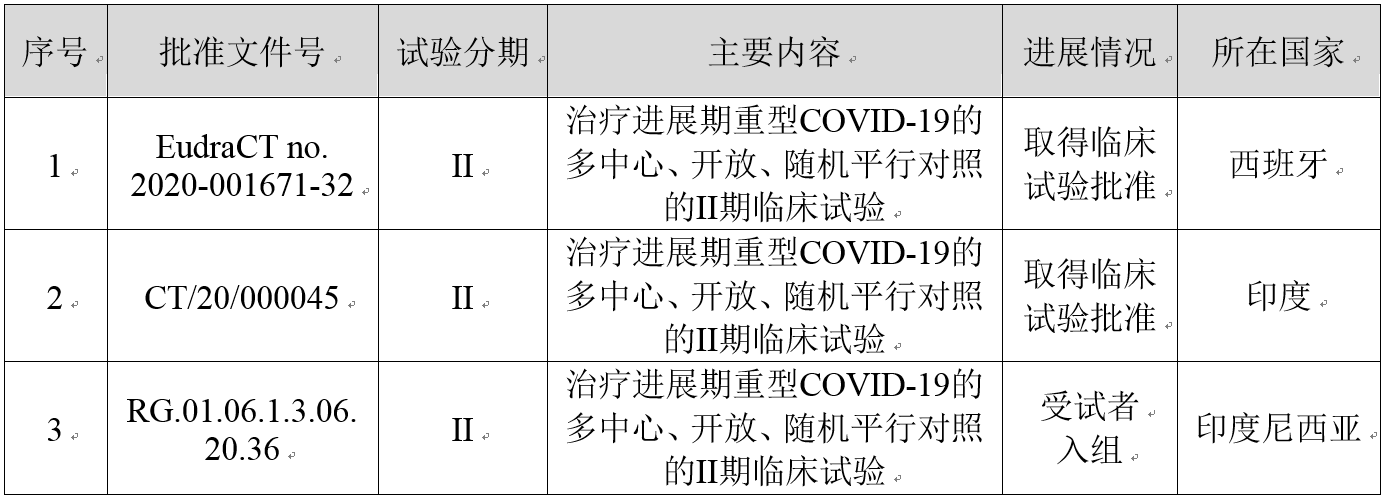
BDB-001注射液在中国共开展4项与新型冠状病毒肺炎相关的临床试验,截至目前的进展情况如下:
BDB-001注射液开展的国际多中心临床试验
BDB-001注射液在海外开展的多中心临床试验的进展情况如下: