对于新型肺炎
我想大家对于“防疫”方面的信息已经都获悉了很多
我们想就医药研发来系列的讲一讲
是否有可能通过研发带给“防疫”工作一些新思路
当然,第一步,我们得先了解这次疫情的“罪魁祸首”
冠状病毒
所谓冠状是对病毒形态的基本分类
如果您一直关注舒泰神
您对另一个词一定不陌生
RNA
HIV病毒虽然长得跟冠状病毒不一样,治病原理和影响器官均存在差别,但是它们都是RNA病毒。
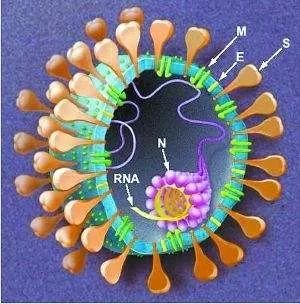
冠状病毒在系统分类上属于冠状病毒科(Coronaviridae)冠状病毒(Coronavirus)。1937年,冠状病毒首先从鸡身上分离出来。1965年,冠状病毒首次从普通感冒病人鼻洗液中发现。由于在电子显微镜下可观察到其外膜上有明显的棒状粒子突起,因此命名为“冠状病毒”。
冠状病毒是由单一的核糖核酸RNA构成,这种RNA和N蛋白共同组成病毒,属于单链RNA病毒。冠状病毒的RNA和RNA之间重组率非常高,因此极易出现变异。
到目前为止,大约有15种不同冠状病毒株被发现,能够感染人、鼠、猪、猫、犬、禽类脊椎动物。其中,感染人的冠状病毒,包括2019新型冠状病毒(2019-nCoV)在内共有7种。
这里要注意一个问题
病毒传染的第一目标是繁衍生息
并非杀死赖以生存的宿主
据了解,全球约30%的上呼吸道感染由HCoV-229E、HCoV-OC43、HCoV-NL63、HCoV-HKU1这四种冠状病毒引起,这四种冠状病毒是仅次于鼻病毒引起普通感冒的第二病因。
但是新千禧年后
来了两个略有不同的冠状病毒新成员
SARS和MERS
SARS(传染性非典型肺炎)冠状病毒,最早于2002年11月在我国广东省被发现,之后,中国香港、越南、新加坡和加拿大报道了类似病例,继而该病毒传播至欧洲和美国。截至2003年7月疫情结束,共报道SARS病例8096例,其中774例死亡,病死率9.6%。2004年上半年,发生了2次小规模暴发,其中1次与该流行病毒的实验室传播有关,另1次可能为接触感染动物所致。之后,未再报道过新病例。
MERS冠状病毒,最早见于2012年9月沙特阿拉伯报告的1例重症肺炎伴急性肾功能衰竭、临床表现类似于SARS的新型冠状病毒感染病例。数日后,英国报告了另1例类似病例,也表现为急性呼吸窘迫综合症和急性肾损伤,该患者有沙特阿拉伯旅行史,在卡塔尔发病,在英国就诊。随后,中东、欧洲相继报告多例类似病例。由于所有报告病例均和中东有流行病学关联,2013年5月23日,世界卫生组织将这种新型冠状病毒感染所致的疾病命名为「中东呼吸综合征」(Middle East Respiratory Syndrome,MERS)。截至2019年11月底,全球共报告中东呼吸综合征(MERS)实验室确认病例2494例,包括858例相关死亡病例(病死率:34.4%)。大多数病例来自沙特阿拉伯(2102例,包括780例相关死亡,病死率为37.1%)。
SARS病毒和MERS病毒所致疾病的严重程度以及社会影响远远超过其它冠状病毒。这两个病毒跟2020年的新型冠状病毒一样,本不存在于人类的感染图谱里,研究者把武汉新型冠状病毒序列与其他两种病毒序列进行了全基因组比对,发现,它跟SARS有约70%的序列相似性,跟MERS有约40%的相似性。也就是说,它更像SARS病毒,而不是MERS病毒。序列差异性主要表现在编码S-蛋白的spike基因上,这是冠状病毒与宿主细胞作用的关键蛋白。
这三个新千年来的冠状病毒都有一个特点叫
外类群病毒
新型冠状病毒和SARS/类SARS冠状病毒在进化上有共同的外类群——一种寄生于果蝠的HKU9-1冠状病毒。所以可以推断,它们拥有一个共同的祖先,是一种和HKU9-1类似的病毒。
这些病毒传染人类的背后,都离不开其他动物的参与。以SARS为例,在果子狸身上,科学家们找到了SARS的早期病毒株。与果子狸接触紧密的多人也成了SARS的感染者。后续的进一步研究发现,果子狸只是“中间宿主”,而病毒的源头可能在于蝙蝠。
MERS病毒则相对更为复杂一些。尽管科学家们也相信这些病毒最初来自蝙蝠,但种种迹象表明,骆驼已成为此类病毒的“储存库”。这就可以解释,为何在人与骆驼多有接触的中东,不断有人类感染MERS病毒的案例;相反,对于SARS而言,由于人类很少有和蝙蝠直接接触的机会,因此在受感染的中间宿主绝迹后,也就没有再观察到新增的SARS病例。
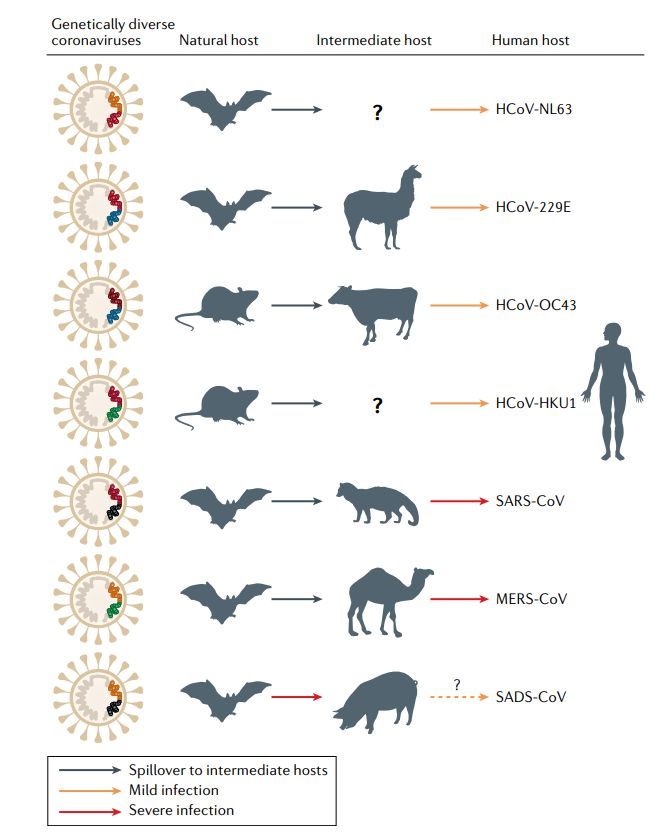
▲冠状病毒均有动物来源(图片来源:参考资料[1])
新病毒挑战
目前我们都有些什么治疗方法?
SARS与MERS两类冠状病毒的结合非常类似。它们均能依靠病毒表面的糖蛋白与细胞表面的受体进行结合,并在细胞质中释放出RNA,指导合成新的病毒颗粒。虽然武汉冠状病毒S-蛋白中5个关键氨基酸有4个发生了变化,但变化后的氨基酸,却整体性上非常完美的维持了SARS病毒S-蛋白与ACE2蛋白相互作用的原来的结构构象,与人ACE2蛋白的亲和力还是很强。此外,这些病毒还有多种策略进行“免疫逃逸”,避免先天免疫系统对其产生响应。
我们目前还缺乏有效的抗病毒疗法,因此只能提供一些其他治疗手段。在2016年发表的相关文章中,作者们指出这些患者接受的大多是利巴韦林与各种干扰素的治疗,有时也会接受广谱抗生素和氧气。在SARS的治疗中,也有利巴韦林结合皮质类固醇的治疗方法。此外,用于治疗HIV感染的lopinavir与ritonavir,也被用于一些冠状病毒感染患者的治疗。
接下来
我们要讲一讲新的治疗策略如何而来
第一种策略 老药新用
先筛选现有的老药,除了是目前最快最便捷的方式外,还有一大原因在于这些药品已获批上市,或至少经过一期人体试验,其安全性数据为人所知,与纯粹新药相比安全性风险小。
这一工作实际已经在临床诊疗中得到应用,随着国家专家组成员王广发的一次采访,艾滋病药物洛匹那韦/利托那韦(克力芝)一夜爆红,并现身国家版诊疗方案。
洛匹那韦/利托那韦是一款复方抗病毒药物,用于艾滋病治疗。据清华大学药学院院长丁胜对界面新闻介绍,洛匹那韦/利托那韦对于艾滋病毒的靶点开发是有效的,而同样的靶点在新型冠状病毒中存在表达。
但这并不能得出洛匹那韦/利托那韦就一定对治疗新型冠状病毒有效的结论。
“两者之间的差别还是比较大的。”丁胜介绍,虽然新型冠状病毒与艾滋病毒存在同一靶点,但蛋白表达并不是完全一样的,两者只是存在相似性;再者,艾滋病毒与新型冠状病毒进入人体后,侵染的细胞是不同的,病毒周期也不一样,这便涉及到药物进入人体内如何代谢,要进入不同器官组织的问题,因此从体外实验所模拟出的药物代谢结果与进入人体内的并不一样。“就算靶点百分百一样,生命周期、侵染细胞也是不一样的。”
简单来说便是,虽然艾滋病毒与新型冠状病毒存在可以让洛匹那韦/利托那韦发挥作用的共同点,但两者依然存在很大差别,影响着洛匹那韦/利托那韦的发挥。
2004年曾有国外研究者开展了临床研究,研究洛匹那韦/利托那韦对SARS病毒的作用,纳入41名SARS患者接受洛匹那韦/利托那韦和利巴韦林联合治疗,并随访3周。监测临床进展和病毒学结果,与111例接受利巴韦林单药治疗的历史对照患者进行比较,结果显示出了一定优势。
丁胜认为,这一临床试验是由历史数据总结的说服力不是很强,可以开展真实世界研究进一步论证。而界面新闻日前从某国内知名三甲医院呼吸科专家处获悉,后续有望开展全国范围的洛匹那韦/利托那韦治疗新型冠状病毒的多中心随机对照试验。上述专家同时透露,在当地确诊病例大多接受了洛匹那韦/利托那韦治疗,但也并非全部有效,也有已治愈患者是未接受洛匹那韦/利托那韦治疗治疗的,该药的效果目前未有定论。
此外还有如勃林格殷格翰的盐酸氨溴索(沐舒坦),被认为可能可以通过与ACE2受体结合。从而对新型冠状病毒起到抑制作用,ACE2受体是SARS病毒与新型冠状病毒与人体细胞结合的受体。界面新闻获悉,目前相关研究团队正与武汉的医院联系,计划开展队列研究。
除了有效性外,另一担忧则在于,一旦新型冠状病毒发生变异,这些老的药物是否还有效?
当前报道显示,如洛匹那韦/利托那韦与盐酸氨溴索、乃至吉利德的埃博拉病毒药物Remdesivir,这样被认为存在治疗潜力的药物并不在少数,但它们都未有切实的临床证据。
第二种策略 疫苗研发
公众的另一期待在于疫苗,如果可以及时开发出新型冠状病毒疫苗,便有可能阻断疫情的持续扩散。
目前,包括中国疾控中心、杭州国家重点实验室、香港大学医学院微生物学系讲座教授袁国勇、强生、斯微生物、Moderna、艾棣维欣生物制药等国内外多个企业与科研机构已宣布启动新型冠状病毒疫苗研发。
但显然,此前所透露出的一些消息引发了公众的误读。
如此前有报道称,国家工程院李兰娟院士曾表示,疫苗成功研制至少还要三个月、斯微生物表示可在40天完成制备等。但事实上,李兰娟也强调要“通过国家一期、二期(临床试验)的验证”,而斯微生物所说的40天完成制备也只不过是做出疫苗样品,而非推向市场,甚至都不是获准开展临床试验的时间。
事实上,与新药研发一样,疫苗从研发到上市也需要一个漫长的过程,经过临床试验验证依然是不可或缺的一环。
第三种策略 新药研发
一般情况下,面对一种新的疾病,通常会开发新的药物,但在目前的情况下,这将会是与时间赛跑。
以如今最为时髦的抗体药物为例,还有一个更为遗憾的点,不光对突发病毒我们不能很快制备抗体药物,即使是了解了很多年的已知病毒,我们成功制造出的抗体药物也屈指可数,准确地说是只有两个,分别是FDA1998年批准的治疗呼吸道合胞体病毒(RSV)的药物Synagis,和FDA 2018年批准的治疗艾滋病毒的药物Trogarzo(插一句,这个药物最初由华裔学者开发,华人的骄傲!)。其中前者是幼儿使用的预防药物,而后者其实并不结合病毒,而是结合人自己细胞上的CD4蛋白,从而阻断病毒进入细胞。所以从严格意义上来讲,人类至今尚未开发出任何一种可以杀死病人体内大量病毒的抗体药物。
说到这,感觉希望很渺茫的样子,但是别急,这里回到一个我们前面介绍病毒时的情况,我问您一个问题:为什么前四种冠状病毒并没有那么高的致死率?后三种病毒一定还干了什么多余的事?
一般来说,有些病毒在与人类长期共生中,已经与免疫系统达成了“共识”。比如大家经常有嘴巴周围“长泡”的情况,在免疫力低下的时候发生,过两天又自愈了。这个是单纯的疱疹病毒,已经和免疫系统形成了一个相互认识的关系,免疫系统认识它又消灭不了它,只好和平共处。
但是,当SARS病毒来临时,人类的免疫系统从来没见过,以为多大的敌人来了,所以把免疫系统都号召起来,“杀”将上去。这时就特别容易发生一个叫做“细胞因子风暴”的情况:即免疫细胞反应太快、过于强烈,以致于最后置人死地的并不是病毒本身,而是病毒引起的免疫反应,这就是我们所说的“不适应。
答案当然是有可能的!

